Сильными электролитами являются, Сильные электролиты – список (химия, 9 класс)

Среди указанных кислот наиболее сильной является 1 кремниевая 2 сероводородная 3 уксусная 4 хлороводородная Например, диссоциация бромида гидроксомагния протекает в соответствии с уравнениями:. Остальные ответы. Степень диссоциации зависит от природы электролита, природы растворителя и от концентрации электролита. Значение фразеологизма «герой нашего времени».
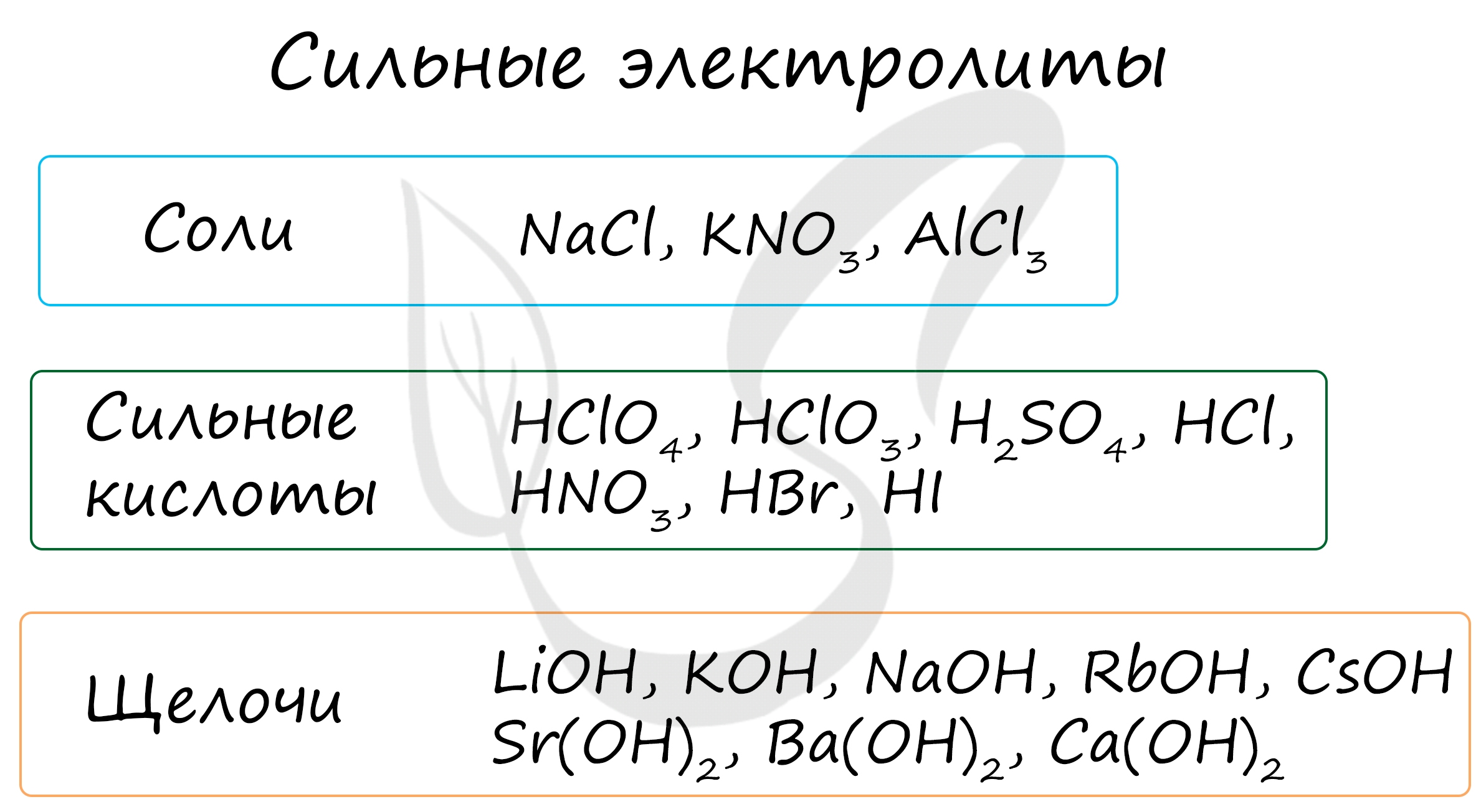
Например, соляная кислота HCl и хлорид натрия NaCl являются сильными электролитами. Наиболее распространенными типами электролитов являются соли, кислоты и щелочи. Соли образуются при диссоциации металлических ионов с кислотными или щелочными ионами. Кислоты диссоциируют на водородные иони протоны и щелочи — на гидроксидные иони.
Электролиты имеют широкий спектр применения в различных областях, таких как химия, биология, медицина и технология. Их свойства и поведение изучают в рамках электрохимии, где они играют важную роль. Сильные электролиты могут быть представлены различными классами соединений, такими как кислоты, щелочи и соли. Важно отметить, что степень диссоциации сильного электролита может быть разной. Сильные электролиты играют важную роль во многих химических процессах и являются фундаментальными для понимания химии растворов и электролитической проводимости.
Их свойства и поведение могут быть изучены и использованы в различных областях, таких как аналитическая химия, фармацевтика, биология и электрохимия. Сильный электролит обладает рядом особых свойств, которые отличают его от слабых электролитов и незаряженных веществ:. Сильные электролиты обычно имеют ярко выраженные кислотные или щелочные свойства и могут быть использованы в различных отраслях науки и промышленности.
Сильный электролит играет важную роль в химии, поскольку он способен полностью ионизироваться в растворе, образуя ионы. Это свойство делает его ценным инструментом для проведения различных химических реакций и исследований.
Во-первых, сильные электролиты используются в качестве электролитов в электрохимических ячейках и батареях. Ионы сильных электролитов эффективно перемещаются между полюсами, обеспечивая поток электрического заряда.
Это позволяет химическим реакциям протекать внутри ячейки или батареи и, таким образом, генерировать электричество. Во-вторых, сильные электролиты применяются в аналитической химии для проведения различных химических реакций и определения концентрации различных веществ.

Например, с помощью сильных электролитов можно провести титрование — метод определения концентрации определенного вещества в растворе, основанный на реакции между реагентами. Кроме того, сильные электролиты используются в процессах электроосаждения и гальванического покрытия.
При электроосаждении ионы сильных электролитов превращаются в элементарные составляющие и осаждается на поверхности металлического предмета, образуя защитное и декоративное покрытие. Посмотрите видео-объяснение темы Преподаватель Фоксфорда всё подробно расскажет и покажет.

Чтобы посмотреть, нужно зарегистрироваться. Содержание Классификация растворов электролитов. Коротко о главном Электролиты — вещества, растворы или расплавы которых проводят электрический ток. Вопросы для самоконтроля Что такое электролиты и неэлектролиты?

Приведите соответствующие примеры. Какие типы связи характерны для электролитов и неэлектролитов? На чём основана классификация электролитов на сильные и слабые? Приведите примеры сильных и слабых электролитов. Понятно Непонятно Войдите или зарегистрируйтесь , чтобы голосовать. А еще вы сможете сохранять статьи в «избранное» и смотреть видеоуроки. Следующая статья. Электролитическая диссоциация. Константа диссоциации: как найти, коэффициент, закон Оствальда. Выбирайте, что поможет вам достичь целей.

Я — Мистер Фокс, ваш онлайн-помощник. Ответьте на несколько вопросов, а я помогу за 5 минут подобрать подходящие варианты обучения. Это бесплатно! Готовая программа с онлайн-занятиями, заданиями и поддержкой куратора. Индивидуальные занятия с удобным расписанием и персональным подходом.
Домашняя школа. Бесплатные занятия. Вещества, которые растворяются в воде с образованием растворов, проводящих электрический ток, называются электролитами.
Процесс распада веществ на ионы - электролитическая диссоциация. Легче всего диссоциируют вещества с ионной связью. При их растворении диполи воды ориентируются вокруг положительного и отрицательного ионов. Между ионами и диполями воды возникают силы взаимного притяжения. В результате связь между ионами ослабевает, разрушается и происходит переход ионов из кристалла в раствор.
При этом образуются гидратированные ионы.