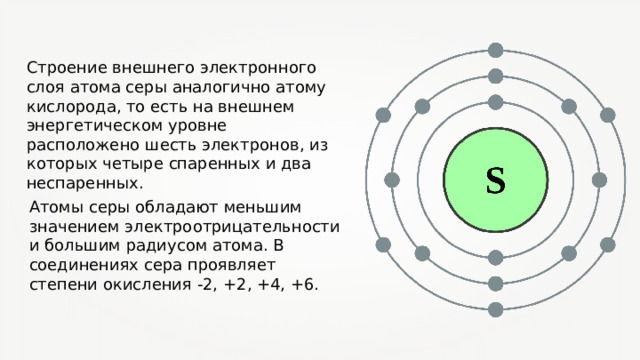
Строение атома s

Опыты Резерфорда. Внешние электроны — всегда валентные, следовательно, 4 s -электроны атома железа — валентные электроны. Энергетические затраты на ионизацию атомов и на присоединение к ним второго или третьего электрона компенсируются за счет энергии, выделяющейся при образовании химических связей.
Но вместе с ними участие в образовании связи может принимать и часть электронов предвнешнего предпоследнего слоя, но только в том случае, если они обладают энергией, не сильно отличающейся от энергии внешних электронов.
И те и другие электроны атома являются валентными. У лантаноидов и актиноидов валентными являются даже некоторые "предвнешние" электроны Энергия валентных электронов намного больше, чем энергия других электронов атома, а друг от друга валентные электроны по энергии отличаются существенно меньше. Внешние электроны — всегда валентные только в том случае, если атом вообще может образовывать химические связи. Так, оба электрона атома гелия — внешние, но назвать их валентными нельзя, так как атом гелия вообще никаких химических связей не образует.
Валентные электроны занимают валентные орбитали , которые в свою очередь образуют валентные подуровни. В качестве примера рассмотрим атом железа, электронная конфигурация которого показана на рис. Следовательно, именно они и являются внешними электронами этого атома.

Внешние электроны — всегда валентные, следовательно, 4 s -электроны атома железа — валентные электроны. А раз так, то и 3 d -электроны, имеющие чуть большую энергию, также будут валентными. На внешнем уровне атома железа кроме заполненной 4 s -АО есть еще свободные 4 p -, 4 d - и 4 f -АО.
Все они внешние, но валентные среди них только 4 р -АО, так как энергия остальных орбиталей значительно больше, и появление электронов на этих орбиталях для атома железа не выгодно.
Итак, у атома железа внешний электронный уровень — четвертый, внешние подуровни — 4 s -, 4 p -, 4 d - и 4 f -ЭПУ, внешние орбитали — 4 s -, 4 p -, 4 d - и 4 f -АО, внешние электроны — два 4 s -электрона 4 s 2 , внешний электронный слой — четвертый, внешнее электронное облако — 4 s -ЭО валентные подуровни — 4 s -, 4 p -, и 3 d -ЭПУ, валентные орбитали — 4 s -, 4 p -, и 3 d -АО, валентные электроны — два 4 s -электрона 4 s 2 и шесть 3 d -электронов 3 d 6.
Валентные подуровни могут быть заполнены электронами частично или полностью, а могут и вообще оставаться свободными. С увеличением заряда ядра уменьшаются значения энергии всех подуровней, но из-за взаимодействия электронов между собой энергия разных подуровней уменьшается с разной "скоростью".
Энергия полностью заполненных d - и f -подуровней уменьшается настолько сильно, что они перестают быть валентными. В случае атома титана 3 d -ЭПУ заполнен электронами только частично, и его энергия больше, чем энергия 4 s -ЭПУ, а 3 d -электроны являются валентными. У атома мышьяка 3 d -ЭПУ полностью заполнен электронами, и его энергия существенно меньше энергии 4 s -ЭПУ, и, следовательно, 3 d -электроны не являются валентными.

В приведенных примерах мы анализировали валентную электронную конфигурацию атомов титана и мышьяка. Валентная электронная конфигурация атома — распределение валентных электронов атома по уровням, подуровням и орбиталям. Валентная электронная конфигурация атома изображается в виде валентной электронной формулы , или в виде энергетической диаграммы валентных подуровней.
На составленных вами энергетических диаграммах и в полных электронных формулах атомов Na, Mg, Al, Si, P, S, Cl, Ar укажите внешние и валентные электроны. Составьте валентные электронные формулы этих атомов. На энергетических диаграммах выделите части, соответствующие энергетическим диаграммам валентных подуровней.
В чем их различия 3. Сколько валентных подуровней в электронной оболочке атома каждого из элементов: а водорода, гелия и лития, б азота, натрия и серы, в калия, кобальта и германия 4. Сколько валентных орбиталей заполнено полностью у атома а бора, б фтора, в натрия? Сколько орбиталей с неспаренным электроном у атома а бора, б фтора, в железа 6. Сколько свободных внешних орбиталей у атома марганца? А сколько свободных валентных?

К следующему занятию подготовьте полоску бумаги шириной 20 мм, разделите ее на клеточки 20? В каждой клеточке поместите символ элемента, его порядковый номер и валентную электронную формулу, как показано на рис.
В основу систематизации химических элементов положен естественный ряд элементов и принцип подобия электронных оболочек их атомов. С естественным рядом химических элементов вы уже знакомы. Теперь познакомимся с принципом подобия электронных оболочек.
Рассматривая валентные электронные формулы атомов в ЕРЭ, легко обнаружить, что у некоторых атомов они отличаются только значениями главного квантового числа. Например, 1 s 1 у водорода, 2 s 1 у лития, 3 s 1 у натрия и т. Это значит, что внешние области облаков валентных электронов таких атомов по форме очень похожи и отличаются только размерами и, конечно, электронной плотностью. А раз так, то электронные облака таких атомов и соответствующие им валентные конфигурации можно назвать подобными.
Для атомов разных элементов с подобными электронными конфигурациями мы можем записать общие валентные электронные формулы : ns 1 в первом случае и ns 2 np 5 во втором. Двигаясь по естественному ряду элементов, можно найти и другие группы атомов с подобными валентными конфигурациями. Таким образом, в естественном ряду элементов регулярно встречаются атомы с подобными валентными электронными конфигурациями. Это и есть принцип подобия электронных оболочек. Попробуем выявить вид этой регулярности.
Для этого воспользуемся сделанным вами естественным рядом элементов.
ЕРЭ начинается с водорода, валентная электронная формула которого 1 s 1. В поисках подобных валентных конфигураций разрежем естественный ряд элементов перед элементами с общей валентной электронной формулой ns 1 то есть, перед литием, перед натрием и т.
Мы получили так называемые "периоды" элементов. Сложим получившиеся "периоды" так, чтобы они стали строками таблицы см. В результате подобные электронные конфигурации будут только у атомов первых двух столбцов таблицы.
Попробуем добиться подобия валентных электронных конфигураций и в других столбцах таблицы. Для этого вырежем из 6-го и 7-го периодов элементы с номерами 58 — 71 и 90 — у них происходит заполнение 4 f - и 5 f -подуровней и поместим их под таблицей. Символы остальных элементов сдвинем по горизонтали так, как это показано на рисунке. После этого у атомов элементов, стоящих в одной колонке таблицы, получатся подобные валентные конфигурации, которые можно выразить общими валентными электронными формулами: ns 1 , ns 2 , ns 2 n —1 d 1 , ns 2 n —1 d 2 и так далее до ns 2 np 6.
Все отклонения от общих валентных формул объясняются теми же причинами, что и в случае хрома и меди см. Как видите, использовав ЕРЭ и применив принцип подобия электронных оболочек, нам удалось систематизировать химические элементы. Такая система химических элементов называется естественной , так как основана исключительно на законах Природы. Полученная нами таблица рис. Познакомимся подробнее со структурой длиннопериодной таблицы химических элементов.
Строки этой таблицы, как вы уже знаете, называются "периодами "элементов. Периоды нумеруются арабскими цифрами от 1 до 7. В первом периоде всего два элемента. Второй и третий периоды, содержащие по восемь элементов, называются короткими периодами. Четвертый и пятый периоды, содержащие по 18 элементов, называются длинными периодами.
Шестой и седьмой периоды, содержащие по 32 элемента, называются сверхдлинными периодами. Столбцы этой таблицы называются группами элементов. Номера групп обозначаются римскими цифрами с латинскими буквами А или В. Традиционное название "благородные газы" также относится к простым веществам Выносимые обычно в нижнюю часть таблицы элементы с порядковыми номерами 58 — 71 Ce — Lu называются лантаноиды "следующие за лантаном" , а элементы с порядковыми номерами 90 — Th — Lr — актиноиды "следующие за актинием ".
Существует вариант длиннопериодной таблицы, в котором лантаноиды и актиноиды не вырезаются из ЕРЭ, а остаются на своих местах в сверхдлинных периодах. Такую таблицу иногда называют сверхдлиннопериодной. Длиннопериодная таблица делится на четыре блока или секции. Элементы s - и p -блоков образуют А-группы, а элементы d -блока — В-группы системы химических элементов.
Все f -элементы формально входят в IIIB группу. Элементы первого периода — водород и гелий — являются s -элементами и могут быть помещены в IA и IIA группы. Но гелий чаще помещают в VIIIA группу как элемент, которым заканчивается период, что полностью соответствует его свойствам гелий, как и все остальные простые вещества, образуемые элементами этой группы, — благородный газ.
Водород же часто помещают в VIIA группу, так как по своим свойствам он существенно ближе к галогенам, чем к щелочным элементам. Каждый из периодов системы начинается с элемента, имеющего валентную конфигурацию атомов ns 1 , так как именно с этих атомов начинается формирование очередного электронного слоя, и заканчивается элементом с валентной конфигурацией атомов ns 2 np 6 кроме первого периода. Это позволяет легко выделить на энергетической диаграмме группы подуровней, заполняющихся электронами у атомов каждого из периодов рис.
Проделайте эту работу со всеми подуровнями, изображенными на сделанной вами копии рисунка 6. Выделенные на рисунке 6. Появление в периодах s -, p -, d - или f -элементов полностью соответствует последовательности заполнения s -, p -, d - или f -подуровней электронами. Эта особенность системы элементов позволяет, зная период и группу, в которые входит данный элемент, сразу же записать его валентную электронную формулу. Что общего между электронными конфигурациями атомов элементов А и В групп?
Чем они различаются? Сколько групп элементов входит в а s -блок, б р -блок, в d -блок? Продолжите рисунок 30 в сторону увеличения энергии подуровней и выделите группы подуровней, заполняющихся электронами в 4-м, 5-м и 6-м периодах.
Перечислите валентные подуровни атомов а кальция, б фосфора, в титана, г хлора, д натрия. Сформулируйте, чем отличаются друг от друга s-, p- и d-элементы.
Объясните, почему принадлежность атома к какому-либо элементу определяется числом протонов в ядре, а не массой этого атома. Для атомов лития, алюминия, стронция, селена, железа и свинца составьте валентные, полные и сокращенные электронные формулы и изобразите энергетические диаграммы валентных подуровней.
Атомам каких элементов соответствуют следующие валентные электронные формулы: 3 s 1 , 4 s 1 3 d 1 , 2s 2 2 p 6 , 5 s 2 5 p 2 , 5 s 2 4 d 2? Для разных целей нам нужно знать либо полную, либо валентную конфигурацию атома. Каждая из этих электронных конфигураций может изображаться как формулой, так и энергетической диаграммой.
То есть, полная электронная конфигурация атома выражается полной электронной формулой атома , или полной энергетической диаграммой атома.
В свою очередь, валентная электронная конфигурация атома выражается валентной или, как ее часто называют, " краткой " электронной формулой атома , или диаграммой валентных подуровней атома рис. Раньше мы составляли электронные формулы атомов, используя порядковые номера элементов.
При этом мы определяли последовательность заполнения подуровней электронами по энергетической диаграмме: 1 s , 2 s , 2 p , 3 s , 3 p , 4 s , 3 d , 4 p , 5 s , 4 d , 5 p , 6 s , 4 f , 5 d , 6 p , 7 s и так далее.
И только записав полную электронную формулу, мы могли записать и валентную формулу. Валентную электронную формулу атома, которая чаще всего и используется, удобнее записывать, исходя из положения элемента в системе химических элементов, по координатам период — группа. Запишите в поле ответа номер периода и номер группы, в которых расположен химический элемент, модель которого изображена на рисунке.
Для записи ответа используйте арабские цифры. Нас спрашивают про номер периода и номер группы. Смотрим, сколько электронных слоёв - их 2. Смотрим, сколько электронов на внешнем электронном слое - их Айгузаль Тороева. Как изображать строение атома. Спас и Мир. Заявление об открытии строения атомных ядер. Модель кольцевого строения атомных ядер. Atom SD. Ruslan Tarasevich. Как работает HF генератор в сварочном инверторе.
Всем привет! Сегодня я хочу рассказать про полезный узел, присутствующий в дорогих сварочных инверторах. Вы никогда не задумывались, почему сварочный шов у хороших и дорогих аппаратов получается более качественный чем у бюджетных? А почему при работе с дорогим аппаратом дуга поджигается легко и без ударений электродом по свариваемой поверхности? Эти полезные свойства обеспечивает узел под названием HF генератор.
Фактически это высоковольтный высокочастотный генератор, выход этого генератора "нагружен" на выходной дроссель сварочного инвертора. Почему я взял слово нагружен в кавычки?
Дело в том, что нагрузка генератора представляет собой петлю 1 виток провода , намотанную на выходной дроссель сварочного инвертора. Так как есть магнитная связь, то мы получаем своего рода ВЧ трансформатор.
При включении функции ВЧ генератора, на электрод подается высоковольтное ВЧ напряжение, и при приближении его к свариваемой детали на расстояние пробоя воздуха, происходит разряд и поджиг дуги.
Дуга возникает еще до касания электродом металла, при этом происходит ионизация атомов газов.
В такой среде дуговой разряд поджигается очень легко и вначале сварки, шов получается без окалин, то есть более качественный. О схеме этого генератора я расскажу в статье. На фото 1 изображена дуга HV HF генератора. На фото 2 изображен "ВЧ трансформатор" , катушка с плоской шиной это выходной дроссель, а коричневые провода - высоковольтный провод.
Напишите в комментариях кому интересна тема сварочных инверторов! Так я пойму стоит ли делать материалы по данной теме. И конечно, поставьте не забудьте поставить лайк и поделиться постом с другом.
Школьная Химия. Решение второго задания ОГЭ. Здравствуйте уважаемые читатели. Сегодня посмотрим решение второго задания ОГЭ по химии. Я думаю, что данное задание является самым лёгким, так как не требует заучивания большого количества материала. Итак, строение атома. Атома состоит из электронов и ядра.
Ядро в свою очередь состоит из протонов и нейтронов. Электроны отрицательно заряженные частицы. Их количество можно определить по порядковому номеру элемента в таблице Д. Например, у алюминия порядковый номер 13, значит и количество электронов тоже Концепт самолета-отеля на атомной энергии.
Как выглядит проект «воздушного «Титаника». Rucars - Новости про электромобили. Химия 10 класс. Арены: определение, особенности строения, номенклатура. На состояние вещества влияет не только его температура. Понятно, что если, например, нагревать стальной образец, то он расплавится, а если охлаждать газ - то он станет сжиженным.
Но вспомните, например, обычный бытовой газ, который можно купить в баллонах. При комнатной температуре в баллоне он не газообразный, а жидкий. Всё дело в том, что газ находится в баллоне под давлением. Если частицы вещества механически "придвинуть" друг к другу, то они смогут образовать связи и вещество перейдет в новое агрегатное состояние. Но всё это было вступлением. Оказывается, если взять самую обычную воду и подвергнуть механическому сжатию, то можно сделать её твёрдой.
Получится лёд с определенной структурой, но при обычной температуре. На приложенной картинке изображена диаграмма зависимости агрегатного состояния воды от давления и температуры. В зоне Solid справедливо ожидать появления твёрдой воды. Правда давления для этого нужны совсем нешуточные.
В лабораториях вполне успешно проводились такие эксперименты. Твёрдое тело, которое получится, будет обладать не совсем стандартной конструкцией кристаллической решетки. Но даже у обычного льда, который получили замораживанием, кристаллические решетки могут отличаться. Известно много различных модификаций.
Все они будут обладать специфической схемой расположения атомов. Кстати, а знаете ли вы, что огонь можно развести с помощью звука? Стрелочками обозначены электроны, которые занимают атомные орбитали. Несколько атомных орбиталей на одном энергетическом уровне образуют подуровни. Можно составить общую табличку с информацией о том, как распределяются электроны по энергетическим уровням и подуровням электронно-графической формулы.
После того, как мы расположили все электроны по своим местам, мы можем составить электронную конфигурацию атома, которая будет отражать порядок заполнения электронов по подуровням в текстовом виде. Исходя из этого, мы можем сказать, что в его атоме:. Проверим себя. В зависимости от положения «последнего электрона» бывают s-, p-, d-, f-элементы :. Главные подгруппы таблицы Менделеева составляют s- и p-элементы, а между ними расположены переходные элементы.
К переходным элементам относятся элементы, которые расположены в побочных подгруппах больших периодов периодической системы Д.
К ним принадлежат d- и f-элементы. Далее приведены электронные формулы атомов элементов первых четырех периодов. Благодаря этой шпаргалке всегда можно сверить свой вариант электронной конфигурации и проверить себя. Переходные элементы очень бережливы в вопросе энергии, они любят расставлять все так, как хочется им.
Как они это делают, мы сейчас и узнаем. Одной из главных особенностей переходных элементов является проскок электрона. Для начала поймем, что же это такое?
Провал проскок электрона — переход электрона с внешнего энергетического уровня на предвнешний нижележащий. Например, у меди электронная оболочка должна выглядеть как.. Но так как для заполнения d-подуровня не хватает одного электрона, то более выгодной становится ситуация, когда с s-подуровня электрон «перепрыгивает» на внутренний d-подуровень.
В результате, конфигурация меди выглядит как 3d 10 4s 1. Итог: иметь конфигурации nd 5 и nd 10 более энергетически выгодно, чем nd 4 и nd 9. Определите, какие из указанных элементов в основном состоянии имеют на внешнем электронном уровне один неспаренный электрон.
Запишите в поле ответа номера выбранных элементов в порядке возрастания. Внешним считается 4 электронный уровень, на нем у нас один неспаренный электрон 4s 1 , вариант ответа нам подойдет. Внешним будет 4 уровень, на нем два спаренных электрона 4s 2. Внешним будет 2 уровень, на котором два спаренных электрона 2s 2 и два неспаренных 2p 2.
Благородные газы не имеют неспаренных электронов , их внешний уровень полностью заполнен. Внешним считается 4 электронный уровень, на нем у нас один неспаренный электрон 4s 1 , вариант ответа нам также подойдет. Сегодня мы с вами узнали, что электроны располагаются в атомах химических элементов в определенном порядке и выявили связь между положением химического элемента в Периодической системе химических элементов Д.